¡Tu carrito está actualmente vacío!
Qué es Agrobacterium
Agrobacterium tumefaciens, sinónimo de Rhizobium radiobacter, especie estandarte de esta enfermedad, es una bacteria (phylum proteobacteria subclase alpha) parásita que causa en las plantas dicotiledóneas una enfermedad llamada «tuberculosis» que provoca tumores conocidos como «agallas», «agallas de la corona», «Crown Gall» o «tumores del cuello». Estos tumores crecen desde la zona donde se unen la raíz y el tallo (cuello), hasta los tallos más finos.
Las bacterias del género Agrobacterium sp., englobadas en la actualidad dentro del género Rhizobium sp. (Young et al. 2001), son bacilos móviles aerobios Gram -, de la familia Rhizobiaceae, la cual también incluye a las fijadoras de nitrógeno que viven en simbiosis con las leguminosas. A diferencia de éstas, todo el género Agrobacterium sp. (actualmente Rhizobium sp., salvo Agrobacterium vitis que podría separarse de este género, debiéndose llamar Allorhizobium vitis – Gan et al. 2018) son parásitos que causan graves daños en más de 600 especies vegetales como albaricoquero (Prunus armeniaca), almendro (Prunus dulcis), arándano (Vaccinium spp.), avellano (Corylus avellana), caqui (palosanto, persimón…, Diospyros kaki), ciruelo (Prunus domestica), cerezo (Prunus avium, Prunus cerasus…), chopo (álamo negro, chopo negro, álamo temblón, álamo blanco …, Populus nigra, Populus alba, Populus tremula), crisantemo (Chrysanthemum sp.), frambueso (en este caso Agrobacterium rubi para Rubus occidentalis, Rubus idaeus…), girasol (Helianthus annuus), manzano (Malus domestica), melocotón (durazno, paraguayo…, Prunus persica), membrillero (membrillo…, Cydonia oblonga), mimbrera (sauce, salguero…, Salix alba, Salix purpurea…), mezereón (matacabras, Daphne mezereum), nogal (Juglans regia), olivo (Olea europaea, véase también la Tuberculosis del olivo provocada por Pseudomonas savastanaoi), peral (Pyrus communis), pimiento (Capsicum annuum), vid (en este caso Agrobacterium vitis para viña…, Vitis vinifera, Vitis rupestris, Vitis riparia, …), tomate (Solanum lycopersicum)…
La primera vez que se describe esta enfermedad fue sobre vid en 1882. En 1907 Erwin F. Smith demuestra la relación de la especie Bacterium tumefaciens con las agallas y tumores que sufren las plantas (Smith y Townsend 1907). Posteriormente fue descrita en multitud de especies (Powell y Gordon 1989). El agente transmisor de esta enfermedad, Agrobacterium tumefaciens (actualmente englobadas en el género Rhizobium) fue descrito en la década de 1930 (Link et al. 1937, de Ropp 1951).

Cómo infecta Agrobacterium a las plantas
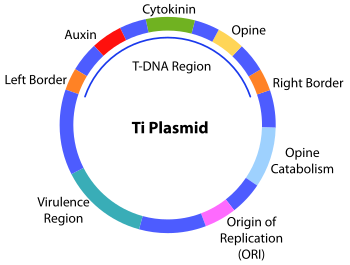
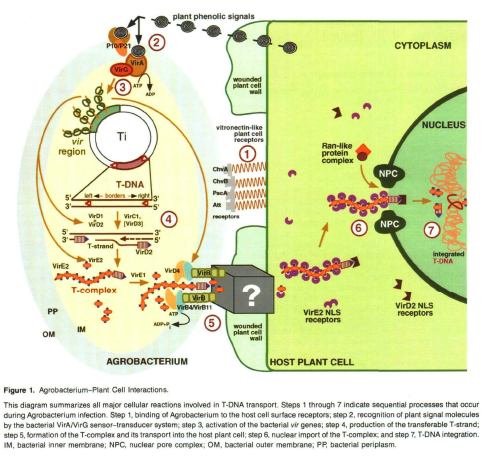
Agrobacterium es una bacteria que, utilizando los propios azúcares de la pared celular, se adhiere a la misma (Braun 1954, Lippincott y Lippincott 1981), para posteriormente transferir proteínas (Vergunst et al. 2003) y genes que provocan que en el citoplasma vegetal se produzcan reguladores del crecimiento vegetal (Ácido indolacético y citoquininas) , de lo cual resulta el desarrollo del tumor. El ADN-T (ADN transferido) también contiene genes codificadores de enzimas que causan que la planta produzca unos aminoácidos específicos llamados «opinas» (Zambryski et al. 1989). Cada tipo de opina (octopina, nopalina, vitopina…) es una fuente de energía específica para cada cepa de Agrobacterium (Rhizobium, Allorhizobium), pero carentes de utilidad para otros organismos. Estas «opinas», además, presentan 2 características que complican aún más el manejo de esta enfermedad:
- Favorecen la transferencia del plásmido Ti, mediante conjugación, a células de Agrobacterium que no eran virulentas. De este modo Agrobacterium asegura el predominio de bacterias virulentas en la población (Petit et al. 1978, Guyon et al. 1980, Ellis et al. 1982a, Ellis et al. 1982b).
- Estimulan la activación de los genes de virulencia (genes vir) del plásmido Ti por compuestos fenólicos de la planta y aumentan la eficacia de la transformación (Veluthambi et al. 1989).
Tras esta transferencia genética, se inicia la multiplicación anormal de células y el posterior desarrollo del tumor ya continúa de forma automática, sin que sea necesaria la presencia posterior de la bacteria.
Agrobacterium, como la inmensa mayoría de bacterias (99%), desarrolla biofilms (Watnick y Kolter 2000, Rudrappa et al. 2008) para invadir la planta, tanto en la parte aérea como en la rizosfera. Mediante esta adhesión mejoran su éxito y además obtienen beneficios de la propia versatilidad de la comunidad multiespecífica a la que pertenece y de su protección frente a sequía, daño por UV, predación, incluso antibióticos.
El proceso de infección descrito depende no sólo de la bacteria, sino que es muy dependiente de aspectos genéticos de la planta (Yi et al. 2002, Lacroix y Citovsky 2022). Desde el vivero debe informarse del grado de sensibilidad frente a Agrobacterium sp. de los clones que se van a utilizar: el uso de clones sensibles o moderadamente sensibles puede potenciar sobremanera la expansión y el daño generado por Agrobacterium.
El plásmido que contiene el ADN que Agrobacterium transfiere a la planta puede ser el plásmido Ri, envuelto en la proliferación de agallas en raíces (Agrobacterium rhizogenes), también llamada enfermedad de la raíz peluda (Gordon y Christie 2015), o bien el plásmido Ti, con información para la proliferación de agallas en la parte aérea:
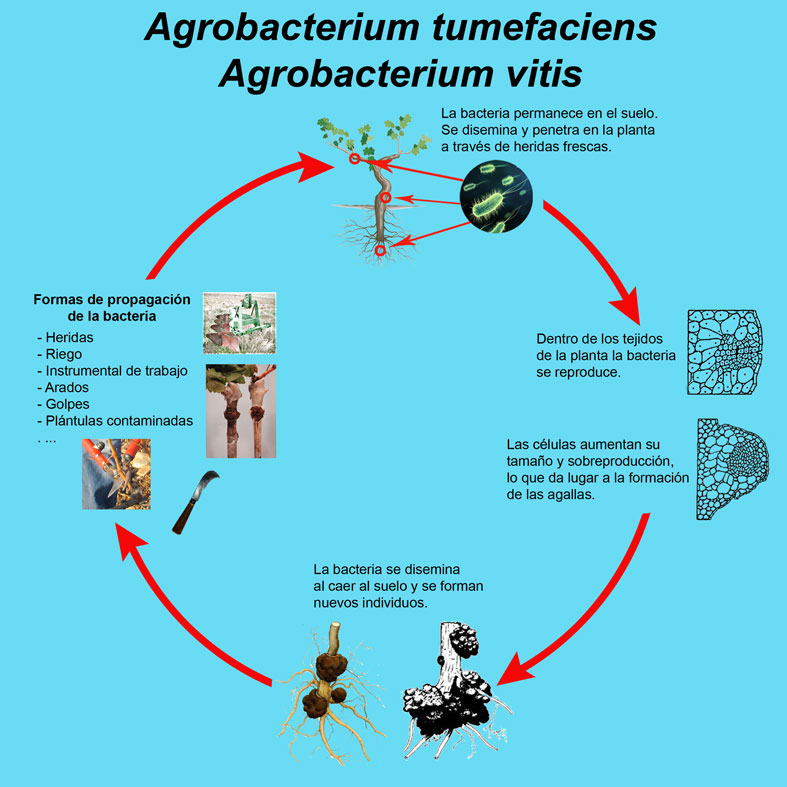
Estas bacterias se pueden detectar en la savia, se desplazan por los vasos y son capaces de infectar los tallos más jóvenes (del año) a partir de tumores en el cuello u otras partes de la planta.

Además, su simple presencia puede amortiguar específicamente las respuestas de defensa de las plantas (Ditt et al. 2005).
Agrobacterium tumefaciens y Agrobacterium vitis pueden estar presentes en la planta sin que se observen síntomas, pero la enfermedad se propagará si el material infectado se usa como fuente de injerto. Agrobacterium vitis presenta 2 particularidades únicas, que le diferencian de Agrobacterium tumefaciens: Capacidad necrogénica (muerte de raíces) (Burr et al. 1998) por capacidad de síntesis de poligalacturonidasa (Rodriguez-Palenzuela et al. 1991) y Capacidad de generar respuestas de hipersensibilidad en especies no hospedantes (Herlache et al. 2001).
Las diversas especies de Agrobacterium requieren de una herida o microlesión para penetrar a la planta. En estas zonas la planta sintetiza unos «marcadores de herida» (polifenoles con grupos 4′-hidroxi,3′-metoxi ó 5′-metoxi y determinados azúcares) que actúan como señales para Agrobacterium. Estas heridas se provocan normalmente por efecto de heladas, ataques de distintos parásitos, poda, golpes, etc. Tras la herida, se produce una «ventana de competencia», que oscila entre 24 y 120 horas, antes del estallido de divisiones celulares que producen la agalla en unas 6 semanas (42 días) (Chi y Smuckler 1981, Binns y Thornashow 1988).
La propagación de la enfermedad se verá favorecida en la medida que aumenten las heridas. Los excesos de abonado nitrogenado, la pérdida de variabilidad genética y la metodología de multiplicación del material vegetal actual están favoreciendo los ataques de esta enfermedad, así como el uso de determinados patrones y variedades que son más sensibles. Es muy importante destacar que Agrobacterium sp. es capaz de dispersarse no sólo a través de las heridas o a través de las labores de vivero, sino que incluso el propio agua de riego puede actuar como vector transmisor de esta bacteria. Tengamos en cuenta que Agrobacterium es un parásito facultativo, siendo capaz de vivir en el suelo durante varios años sin presencia de plantas a las que invadir (saprófito).
La presencia de Agrobacterium vitis en la microbiota de la agalla casi siempre se acompaña de otras bacterias como Xanthomonas sp. , que aprovecha la presencia de sustratos asociados con el crecimiento y la reparación de la pared celular vegetal, y Novosphingobium sp. que resulta útil para Agrobacterium al promover la propagación del plásmido pTi y Microbacteriaceae sp. (Gan et al. 2019).

Daños y Síntomas característicos de Agrobacterium
Daños económicos
Económicamente, la pérdida de vigor es una de las causas, a nivel planta, que provoca pérdidas significativas. Es en los viveros e invernaderos donde esta enfermedad es más perjudicial pues afecta gravemente al valor comercial de las producciones. Aunque no se dispone de datos recientes de evaluación de las mismas en Europa, existen datos de Estados Unidos y Canadá (Pulawska 2010). La legislación de la Unión Europea considera a Agrobacterium como patógenos de calidad, por lo que los lotes de plantas con más del 2-10% de plantas, variable según la especie, no pueden ser comercializados (Directiva 92/323). En África y Sudamérica, Agrobacterium es considerado patógeno de cuarentena.
López (2001) indica que la incidencia en España es especialmente preocupante en frutal de hueso, donde algunos patrones como los híbridos de melocotonero x almendro presentan una elevada sensibilidad a Agrobacterium. Le sigue en importancia los ataques en viña, donde se están detectando con muy elevada frecuencia en todas las zonas vitícolas del país (Lastra 1998, Palacio-Bielsa et al. 2009).
Sintomatología
Ir a sintomatología más compleja.
La sintomatología característica de Agrobacterium tumefaciens y/o Agrobacterium vitis es la presencia de las agallas o tumores en cuello, raíz y tallos que pueden tener distintos aspectos: lisos, rugosos, aislados, agrupados, etc.
Las agallas son fácilmente visibles en la superficie del tallo. Son variables en estructura interna. Carecen de epidermis, es decir, sin protección externa, y por tanto, a todos los efectos son heridas abiertas, a través de las cuales penetran otras enfermedades. Algunas permanecen como masas indiferenciadas de células con una estructura vascular interna mal definida. Otras agallas contienen áreas diferenciadas en la masa central, con placas cribosas visibles y otros elementos vasculares. Estas diferencias varían con la planta estudiada (girasol en Chi & Smuckler 1981, kalanchoe y zanahorias en Lippincott & Lippincott 1981).
En raíz y cuello los tumores al principio son blandos y de color claro para posteriormente endurecerse y tomar un color pardo u oscuro. En tallos y brazos, los tumores pueden ser aislados pero también son frecuentes en los desgarramientos longitudinales de la corteza formándose en el interior de las heridas numerosos tumores. Los tumores en nudos, heridas, o en el punto de injerto, pueden ser confundidos con callos de cicatrización. En general, debido a las altas posibilidades de confusión, sólo la experiencia o el análisis en laboratorio permitirán identificar a Agrobacterium sp. como causante de los síntomas presentes.
Agrobacterium sp. no es ni el único, ni el más común causante de tumores en las plantas. Muchos pueden ser causados por insectos o larvas que segregan ciertas sustancias que producen el mismo efecto aparente (Kalil y Hildebrandt 1981).




Si continúa interesado en conocer más síntomas que provoca Agrobacterium en las plantas, pinche aquí para acceder a la página en la que se describen otros síntomas menos conocidos por el personal técnico, con elevada incidencia, generadores de daño y pérdida de calidad y producción.
Contacto
Si quiere contactar con nosotros, rellene este formulario de contacto
* Si no dispone en estos momentos de determinada información que cree puede resultar necesaria para resolver su consulta, tiene la posibilidad de Rellenar parcialmente este formulario de consulta y guardarlo. Se creará un enlace automático para que una vez haya recopilado lo necesario pueda volver a acceder al mismo y finalizar su consulta.
Contenido